ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Журнал "Гастроэнтерология" Том 51, №1, 2017.
Хронічні запальні захворювання кишечника (ХЗЗК), а саме неспецифічний виразковий коліт (НВК) та хвороба Крона (ХК), привертають увагу як лікарів, так і науковців у всьому світі. Це обумовлено тим, що майже 1,5 млн осіб у США та понад 2 млн — у Європі страждають від ХЗЗК. Незважаючи на прогрес, що досягнуто останніми десятиріччями, щодо вивчення патогенезу цих захворювань, причина їх залишається невідомою, тому етіологічної терапії не існує. Крім того, відзначена тенденція до зростання числа тяжких, резистентних до лікування форм захворювань, ускладнень та оперативних втручань, що призводять до інвалідизації пацієнтів молодого, працездатного віку.
Ключові слова: обзор; виразковий коліт; хвороба Крона; фекальний кальпротектин; лактоферин; лізоцим; еластаза; мієлопероксидаза; α1-антитрипсин.
ЛАБОРАТОРІЯ УЛДЦ ПРОВОДИТЬ ДОСЛІДЖЕННЯ:
- фекальний кальпротектин;
- лактоферин та кальпротектин у фекаліях;
- перинуклеарні антинейтрофільні цитоплазматичні антитіла (п-АНЦА, р-АNСА) – антитіла до мієлопероксидази;
- еластаза підшлункової залози в сироватці;
- еластаза підшлункової залози в калі;
- альфа-1-антитрипсин.
ХЗЗК характеризуються наявністю запально-деструктивних змін у кишечнику і рецидивуючим перебігом [1].
ХК розвивається сегментарно, у всіх відділах шлунково-кишкового тракту (ШКТ) і вражає всі шари стінки кишечника [2].
НВК, як правило, починається з прямої кишки і звідти поширюється на всі відділи товстого кишечника, вражаючи в основному його слизову оболонку [3, 4, 23]. Проблема діагностики запальних захворювань кишечника вважається тяжкою та актуальною з урахуванням значної поширеності даної патології. Поширеність НВК становить 70–150 на 100 тис. населення в країнах Західної Європи. Щорічно реєструється 6–15 нових випадків захворювання на 100 тис. населення [5]. Кількість хворих на ХК у світі дещо менша — 50–70 випадків на 100 тис. населення, але ситуація прогресивно погіршується, і останніми десятиріччями їх кількість збільшилася в декілька разів [24]. Крім того, питання діагностики кишкової патології викликають деякі труднощі серед практикуючих лікарів загального профілю.
Дослідження останніх років спрямовані на розробку адекватних методів діагностики та лікування ХЗЗК, метою яких є досягнення клінічної та ендоскопічної ремісії захворювань, запобігання рецидивам і покращання якості життя хворих.
Поліморфізм клінічної маніфестації хвороб, різноманітність форм залежно від локалізації ураження, тяжкості перебігу, наявності позакишкових проявів та ускладнень потребують колегіального вирішення стратегії лікування хворих на ХЗЗК за участю гастроентерологів і хірургів-проктологів.
У 2000 році засновано Європейську організацію хвороби Крона та виразкового коліту, до складу якої увійшли провідні спеціалісти з проблеми ЗЗК. Основні завдання цієї організації — сприяння проведенню наукових досліджень, навчання та підвищення кваліфікації спеціалістів, створення єдиного погляду на проблему ЗЗК, що сприяє оптимізації лікування хворих. Перший Європейський консенсус із діагностики та лікування ХЗЗК було опубліковано у 2006 році. Наступного року деякі положення консенсусу було переглянуто та доповнено на підставі результатів нових клінічних досліджень, що відображено в консенсусі 2010 року [6].
Діагностика ХЗЗК базується на повсюдно прийнятих стандартах: стандартні методи обстеження, лабораторні дослідження (загальний аналіз крові, С-реактивний білок (СРБ), печінкові та ниркові проби, копрограма, бактеріологічний посів калу на мікрофлору кишечника), ультразвукове дослідження органів черевної порожнини, іригографія [4, 5, 7, 8]. При тяжкому перебігу захворювання для виключення токсичної дилатації товстого кишечника слід проводити оглядову рентгенографію черевної порожнини [25].
Проте на сьогодні головне місце в діагностиці НВК і ХК займають ендоскопічний і морфологічний методи [9–12], що дозволяють візуально та морфологічно оцінити ступінь активності процесу і визначити його поширеність. Але навіть виконані ендоскопічне та морфологічне дослідження кишечника не завжди спроможні забезпечити точність установленого діагнозу і підтвердити або спростувати наявність запалення [13, 26]. Інколи буває тяжко отримати зразки тканини хворого під час дослідження, а в деяких випадках — і взагалі неможливо. Існує досить багато факторів, що заважають цьому, наприклад відсутність ретельної підготовки
кишечника, тяжкий стан хворого та інше. Тому така складна та багатообіцяюча процедура, як фіброколоноскопія, далеко не завжди ставить останню крапку в діагостичному пошуку лікарів [14]. Вищезазначене також належить і до морфологічних аналізів. Неретельно взяті зразки слизової оболонки, погана їх якість сприяють тому, що морфологи також не можуть визначитись зі станом кишечника і, таким чином, ніяк не допомагають клініцистам у діагностичному пошуку. Не слід забувати при цьому, що «морфологічний вирок» залежить тільки від лікаря-морфолога, його досвіду та знань, тому про об’єктивність результатів дослідження можна казати лише взагалі і далеко не в кожному разі.
Незважаючи на велику кількість і різноманітність діагностичних тестів і процедур, що використовуються для визначення стану кишечника, установлення й оцінка кишкового запалення залишаються тяжкою задачею. Навіть виконане ендоскопічне та морфологічне дослідження кишечника не завжди спроможні забезпечити точність установленого діагнозу і підтвердити або спростувати наявність запалення. Тому лікарі гостро відчувають потребу у впровадженні високоякісного, нескладного та доступного методу, що швидко та з високим відсотком точності буде допомагати їм із визначенням стану кишечника [13, 26].
Також розроблено декілька індексів оцінки активності запалення, таких як запропонований Best-індекс активності ХК (CDAI), індекс активності НВК (UCAI) та індекс активності Harvey — Bradsaw, в основі яких лежить сукупність даних фізикальних, лабораторних та інструментальних методів дослідження [15, 16, 27, 28].
Використання клінічних індексів запалення, наприклад індексу активності хвороби Крона за Best, індексу активності неспецифічного виразкового коліту за Truelove і Wittz або індексу активності Harvey — Bradsaw, більше відображає якість життя пацієнта, ніж ступінь запалення слизової оболонки [17, 29, 30]. Тобто загальноприйняті методи та алгоритми діагностики, що використовуються протягом багатьох років, мають обмежені можливості.
Більш перспективними і високочутливими методами оцінки ступеня кишкового запалення вважаються кількісні визначення в калі α1-антитрипсину, нейтрофільної еластази, фактора некроза пухлини та інших неінвазивних маркерів місцевого запалення, збільшення вмісту яких засновано на підвищенні дифузії плазмових протеїнів, нейтрофілів у кишкову стінку при запаленні [4, 17].
α1-антитрипсин діє як первинний інгібітор еластази поліморфноядерних нейтрофільних гранулоцитів (PMN-еластази ) і секретується під час запалення, знижуючи протеолітичну активність PMN-еластази в місці запалення. Крім того, через утворення комплексу інгібує групу серинових протеаз, що беруть участь в утворенні згустку, трипсину, хімотрипсину і т.п. Таким чином, α1-антитрипсин грає важливу роль в антизапальній відповіді. α1-антитрипсин — лінійний глікопротеїн із молекулярною масою 52 кДа (394 амінокислотні залишки), із вільним цистеїновим залишком і трьома бічними вуглеводними ланцюгами. Синтезується переважно в
печінці, а також макрофагами, моноцитами та епітеліальними клітинами слизової оболонки кишечника. α1-антитрипсин є основним інгібітором серинових протеаз у плазмі людини. Також доведено, що фекальний α1-антитрипсин — важливий маркер інтестинальної втрати білка та підвищеної проникності кишечника, оскільки він стійкий до деградації в кишечнику за рахунок своєї антипротеолітичної активності. Крім того, вимірювання концентрації фекального α1-антитрипсину використовують для оцінки та моніторингу хронічних запальних захворювань кишечника. У клінічній практиці оцінка кліренсу α1-антитрипсину (співвідношення рівнів α1-антитрипсину в калі та крові) краща порівняно з єдиним визначенням у калі: хибнонегативні та хибнопозитивні результати знижуються на 21 %. Метод більш чутливий порівняно з рутинними методами і сприяє визначенню концентрації білка в супернатантах клітинних культур, а також успішному розпізнаванню як печінкової, так і кишкової форми α1-антитрипсину. Даний метод — перспективна альтернатива методу радіальної імунодифузії, особливо при великій втраті білка. Комбінація двох типів специфічних антитіл знижує кількість хибнонегативних результатів, гарантуючи надійну діагностику. Показаннями до призначення α1- антитрипсину в калі та крові є синдром втрати білка через кишечник та порушення інтестинальної проникності; хвороба Крона; некротичний ентероколіт; запалення вірусного, бактеріального або алергічного походження. Таким чином, це новий, простий у використанні та неінвазивний тест для визначення інтестинальної втрати білка.
Ці методи є більш специфічними, не вимагають спеціальної підготовки хворого перед дослідженням і мають неінвазивний характер. Крім того, точність результатів даних методик високо корелює з ендоскопічними та гістологічними даними оцінки ступеня вираженості кишкового запалення [8, 31]. Однак висока нестабільність цих протеїнів у матеріалі і неможливість тривалого зберігання із збереженням початкових концентрацій не дають змоги використовувати ці методики як рутинні тести.
У країнах Західної Європи золотим стандартом аналізу активності запалення при запальних захворюваннях кишечника вважається метод оцінки фекальної екскреції лейкоцитів, мічених індієм-111 або технецієм-99 [32]. Метод базується на доведеній активній міграції нейтрофілів із кровотоку в уражений кишечник, що в разі загострення хронічних запальних захворювань кишечника збільшується в 10 і більше разів [33]. Пацієнту попередньо внутрішньовенно вводять суспензію лейкоцитів, мічених вищевказаними нуклідами, середній вміст гранулоцитів у введеному препараті становить 1,4 • 108/мл, потім проводиться серія абдомінальних сцинтиграм: через 30 хвилин, 1 годину, 3 та 24 години з моменту внутрішньовенної ін’єкції [33]. Також пацієнт збирає всі порції калу протягом 3 діб, і згодом в умовах радіонуклідної лабораторії роблять оцінку екскреції мічених лейкоцитів. Точність діагностики вищевказаного методу досить висока і становить, за даними різних авторів, від 48 до 92 %, у середньому — 84,5 %. Більше того, абдомінальна сцинтиграфія, що виконують після ін’єкції мічених лейкоцитів, може використовуватися для визначення наявності, розташування і протяжності кишкового запалення, та вимірювання тридобової фекальної екскреції мічених індієм-111 лейкоцитів забезпечує пряму кількісну оцінку кишкового запалення [34]. Як бачимо, метод оцінки фекальної екскреції мічених лейкоцитів достатньо високоінформативний та показує багатообіцяючі результати. Але разом із тим він досить складний у проведенні, вимагає технічно оснащеної лабораторії, спеціальної підготовки медичного персоналу. Крім того, під час дослідження пацієнт піддається дії іонізуючого випромінювання 8,5–17 мілізивертів (mSv), тобто дози, еквівалентної або навіть більшої, ніж рентгенологічне дослідження з барієм. Це обмежує його використання в дітей, підлітків та жінок дітородного віку. Також не можна не враховувати високу вартість самих радіонуклідів, що в результаті робить метод економічно невигідним — близько 300 фунтів на одного пацієнта [32, 35].
До того ж є практичні проблеми з отримання всіх фекалій хворого за 3 доби. Таким чином, незважаючи на високу інформативність, метод оцінки фекальної екскреції лейкоцитів, мічених індієм-111, має обмежені можливості для проведення і не може бути розглянутий як скринінг дослідження. Тому постійно йде пошук нових методів діагностики, що відповідають основним вимогам, таким як простота проведення, відсутність спеціальної підготовки пацієнта до дослідження, відсутність супутнього ризику для здоров’я хворого, неінвазивність, високі чутливість і специфічність, економічна доступність, особливо у випадках необхідності диференціальної діагностики хронічних запальних і функціональних захворювань кишечника.
В Україні, Росії та інших країнах СНД у хворих на ХЗЗК значно поширено проведення аналізу крові на СРБ та підвищення рівня лейкоцитів у крові. Безумовно, СРБ і рівень лейкоцитів вважаються легко визначними параметрами і система їх оцінки доступна при будь-якому рівні надання медичної допомоги [1, 18–20, 36–39].
У здорових осіб С-реактивний білок знаходиться в сироватці в концентрації 5 мг/л. Зростання його рівня є неспецифічною реакцією і починається до розвитку клінічних ознак захворювання. Доведено прямий зв’язок між зміною рівня СРБ і тяжкістю клінічних проявів запалення [39–41]. Відзначається певна кореляція між активністю хвороби Крона або виразкового коліту і ступенем підвищення СРБ.
Щодо функціональних розладів в організмі людини, то при цих станах рівень СРБ не змінюється. Саме тому дотепер СРБ вважався найчутливішим і специфічним клініко-лабораторним індикатором запалення та некрозу [37].
Проте при всьому вищезгаданому головним недоліком цього методу є те, що рівень СРБ вказує на наявність запального процесу, але не вказує на його локалізацію. Високі концентрації СРБ можуть спостерігатись як і при ХЗЗК, так і при багатьох інших патологіях, не пов’язаних із ШКТ. Окрім того, при ХК підвищення СРБ корелює зі ступенем вираженості запального процесу, а при НВК подібна тенденція не спостерігається [36, 42].
Ідеальний лабораторний метод дослідження, на думку провідних фахівців, повинен відповідати таким вимогам: бути простим, швидким, відносно недорогим, специфічним для даного захворювання, давати можливість оцінювати активність хвороби та здійснювати моніторинг ефективності терапії, а також прогнозувати ймовірність рецидивів.
Хоча в рутинній практиці дотепер не впроваджено визначення фекальних маркерів, зокрема кальпротектину, поліморфноядерної еластази, лактоферину, методом імуноферментного аналізу, ці малоінвазивні методи заслуговують на увагу, і в комбінації з оцінкою СРБ та клінічних даних можуть бути використані для визначення активності та протяжності патологічного процесу при ЗЗК [6]. Отже, лактоферин — поліфункціональний білок родини трансферинів. Лактоферин є глобулярним глікопротеїном із молекулярною масою близько 80 кДа і широко представленим у різних секреторних рідинах, таких як молоко, слина, секрет носових залоз. Лактоферин є представником системи неспецифічного гуморального імунітету, регулює функції імунокомпетентних клітин і належить до білків гострої фази запалення. Лактоферин наявний у слизу кишечника більше,ніж в інших біологічних рідинах, чинить певну антибактеріальну дію та має стійкість до протеолізу в калі. Він експресується активованими нейтрофілами, і його виявлення в калі свідчить про наявність запалення слизової оболонки товстої кишки [43]. Як установлено R. Sidhu та співавт. (Велика Британія) та L. Langhorst зі співавт. (Німеччина), концентрація лактоферину в калі хворих на НВК та ХК перевищує таку в пацієнтів із синдромом подразненої кишки (СПК). Лактоферин може бути виявлений за допомогою простих і недорогих методів імуноферментного аналізу, оскільки він має відмінну стабільність у калі протягом 4 днів. Фекальний лактоферин вимірюється за допомогою ELISA на одному зразку калу. Концентрація фекального лактоферину у здорових осіб становить 1,45 ± 0,40 µг/г фекалій. При запаленні концентрація лактоферину може зростати до кількох сотень [44].
Чутливість та специфічність фекального лактоферину для виразкового коліту становили 92 та 88 % відповідно, а для хвороби Крона — 92 та 80 % відповідно [45].
Рівень фекального лактоферину може значно підвищуватися до клінічно очевидного рецидиву і може бути добрим маркером для прогнозування наступних спалахів запальних захворювань кишечника. Визначення лактоферину використовують для моніторингу активності виразкового коліту та хвороби Крона і як метод диференціальної діагностики хвороби Крона та СПК [45–48].
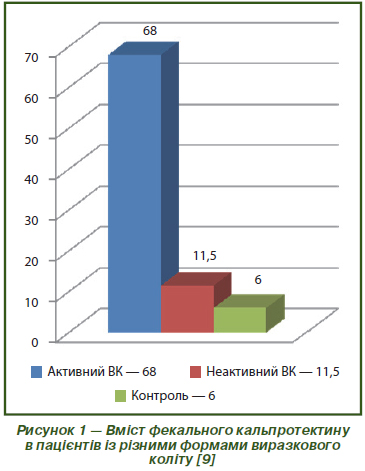
Значний інтерес дослідників спрямований на визначення фекального кальпротектину у хворих на ХЗЗК. Кальпротектин — кальцій- та цинкзв’язуючий білок, що міститься в цитоплазмі нейтрофілів та макрофагів. Він звільняється з клітин при стресі або пошкодженні та потрапляє в калові маси. Одне з перших досліджень кальпротектину було проведено в Норвегії в 1997 р. A.G. Roseth et al. Було оцінено вміст фекального кальпротектину в пацієнтів з активним НВК, неактивним НВК та в контрольній групі. Його зміст становив відповідно 68, 11,5 та 6 мг/л. Був зроблений висновок щодо можливості застосування фекального кальпротектину як маркер активності захворювання (рис. 1) [49–51].
У дослідженні J. Tibble et al. (2000) було встановлено, що з урахуванням верхньої норми вмісту фекального кальпротектину 30 мг/л даний тест має 100% чутливість і 97% специфічність у диференціації між ХК та СПК [52, 53].
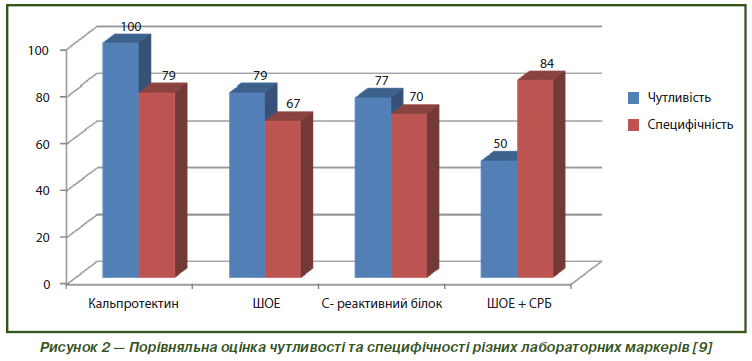
Дослідження кальпротектину та лактоферину в калі пацієнтів, які після колоноскопії були розподілені на групи — із СПК та ХЗЗК, показало, що чутливість фекальних тестів для кальпротектину становила 100 %, для лактоферину — 78 %; специфічність була, навпаки, дещо вищою для лактоферину. Був зроблений висновок, що швидкі фекальні тести можуть бути добрими неінвазивними методами для виключення ХЗЗК, особливо на етапі первинної медичної допомоги (Otten C.M., 2008) [6, 54]. Оцінка чутливості та специфічності підвищення фекального кальпротектину, підвищення швидкості осідання еритроцитів (ШОЕ), рівня С-реактивного білка, одночасного підвищення С-реактивного білка та швидкості осідання еритроцитів у диференціальній діагностиці ХК і СПК була проведена в дослідженні S. Dolvani et al. Його результати: чутливість становила відповідно 100, 79, 77, 50 %; специфічність — 79, 67, 70, 84 %. Авторами роботи був зроблений висновок про переваги використання саме кальпротектину як лабораторного маркера (рис. 2).
Фекальний кальпротектин є маркером інтестинального запалення і дозволяє неінвазивно диференціювати синдром подразненого кишечника і запальні захворювання кишечника, дає можливість моніторувати перебіг хвороби/терапію хвороби Крона та виразкового коліту, є потенційним скринінговим маркером колоректальної неоплазії. Визначення фекального кальпротектину дає можливість отримати перші результати без радіологічного та ендоскопічного дослідження, оскільки його рівень також корелює з гістологічною та ендоскопічною оцінкою активності хвороби Крона та виразкового коліту, як і з визначенням екскреції мічених ізотопом індію-111 нейтрофілів, що вважають золотим стандартом в оцінці активності запальних захворювань кишечника. Але ізотопний метод дуже дорогий, вимагає госпіталізації пацієнта, до того ж за експозицією радіоактивної речовини непридатний для дітей та вагітних.Детальне вивчення діагностичного значення фекального кальпротектину було проведено у 2008–2010 рр. на кафедрі гастроентерології та терапії ФПО ДЗ «Дніпропетровська медична академія МОЗ України».
Перевагами визначення фекального кальпротектину є те, що метод має високу діагностичну цінність: низька концентрація в калі означає відсутність органічного захворювання кишечника (специфічність для синдрому подразненого кишечника — 100 %); чутливість для хвороби Крона становить до 100 %, специфічність — 97 %; відмічаються висока стабільність фекального кальпротектину в калі протягом декількох днів; неінвазивність (метод знижує кількість болючих досліджень), швидкість.
Показаннями до визначення фекального кальпротектину є диференціальна діагностика хвороби Крона та СПК; оцінка стадії/ступеня запальних захворювань кишечника; параметр моніторингу хвороби Крона, виразкового коліту, пацієнтів після видалення поліпів [21].
В іншому дослідженні проводилось вивчення фекальної поліморфнонуклеарної (ПМН) еластази. Слизова оболонка кишки при ЗЗК дифузно й інтенсивно інфільтрована лімфоцитами, плазмоцитами та нейтрофільними лейкоцитами, що продукують лактоферин, лізоцим, еластазу, мієлопероксидазу та кальпротектин. ПМН-еластаза — це глікопротеїн із групи серинових протеаз. ПМН-еластаза була визначена у двох незалежних популяціях із запальним захворюванням кишечника. Проводилось дослідження в пацієнтів із хворобою Крона та в пацієнтів із НВК із різним ступенем активності. Рівні ПМН-еластази в плазмі були статистично значимо вищі в пацієнтів з активним, ніж із неактивним ступенем запалення. Рівень ПМН-еластази в калі був також вищим у пацієнтів із хворобою Крона і активним НВК, але різниця досягла значень тільки при хворобі Крона. Маркер запальних захворювань може викликати серйозні пошкодження в місці секреції. Особливо це стосується хвороби Крона, характеризується зростанням фагоцитарної активності та підвищеною секрецією ПМН-еластази і інших лізосомальних ферментів. Показаннями для визначення ПМН-еластази є: активація хвороби Крона і диференціальна діагностика хвороби Крона та СПК [22].
Було встановлено, що при активних формах НВК та ХК усі ці показники є значно вищими, ніж при неактивних формах ХЗЗК та при СПК. Діагностична цінність при ХЗЗК була такою: фекальний кальпротектин — 80,0 %, фекальний лактоферин — 80,0 %, фекальна поліморфнонуклеарна еластаза — 74,1 %, сироватковий СРБ — 80,0 %. Було відмічено, що найбільшу діагностичну цінність для ХК мало визначення кальпротектину (81,4 %), для НВК — лактоферину (83,3 %) [9, 22].
У дослідженні Н. Silberer та співавт. (2005) була проведена оцінка діагностичної значущості фекальних кальпротектину, лактоферину, фекального лізоциму, мієлопероксидази, поліморфонуклеарної еластази в диференціальній діагностиці між СПК та ХЗЗК. Лізоцим у калі (мурамідаза) — білок із молекулярною масою 15 кДа, має бактерицидну активність, належить до групи лужних гликозидаз. Лізоцим продукується гранулоцитами, моноцитами та макрофагами. Основне джерело лізоциму в калі — інтестинальні гранулоцити. Він може визначатися в запальному інфільтраті в гострий період хвороби Крона. Також лізоцим активно секретується мононуклеарами в просвіт кишки. Є pANCA-антигеном, антитіла до нього з високою частотою відмічаються при запальних захворюваннях кишечника, наприклад при виразковому коліті. Це дослідження було зроблено з метою визначити, чи є вимірювання фекального лізоциму корисним для визначення активності хвороби при запальних захворюваннях кишечника. Фекальні концентрації лізоциму були значно більші при хворобі Крона та виразковому коліті, ніж у контрольній групі. При виразковому коліті концентрація фекального лізоциму була збільшена в активній стадії запалення порівняно з неактивною стадією. Вимірювання фекального лізоциму мало допомагає в діагностиці та визначенні активності хвороби запального захворювання загалом, але воно може бути корисним для діагностики й оцінки активності пошкодження ободової кишки при запальних захворюваннях кишечника, а також для диференціації СПК із ХЗЗК [34].
Показаннями до призначення фекального лізоциму є: діагностика та моніторинг хвороби Крона; бактеріальні, вірусні, алергічні та автоімунні запальні захворювання кишечника; диференціальна діагностика СПК та запальних захворювань кишечника [55, 56].
Останнім часом все більше уваги привертає дослідження фекальної мієлопероксидази. Гранули нейтрофілів містять велику кількість різних ферментів. Мієлопероксидаза каталізує окислення з утворенням токсичних для мікроорганізмів перекисних продуктів. Ефективність руйнуючої бактерії дії підсилюється під дією еластази поліморфноядерних лейкоцитів. Концентрація мієлопероксидази також пропорційна кількості нейтрофілів у межах цієї ділянки. Петерсон та інші виявили зв’язок між рівнями фекальної мієлопероксидази та гістологічними показниками активності захворювання у хворих на виразковий коліт [57, 58]. Аналогічним чином Вагнер та інші показали, що фекальна мієлопероксидаза потенційно може бути використана як сурогатний маркер успішного результату лікування у хворих на запальні захворювання кишечника, подібно до кальпротектину. Визначення мієлопероксидази в калі відображає активність хвороби Крона та виразкового коліту [59].
Подальші дослідження необхідні, щоб визначити клінічну роль фекальної мієлопероксидази при запальних захворюваннях кишечника.
Дана інформація завжди корисна для лікуючих лікарів, оскільки це впливає на тактику лікування, його тривалість і зачіпає такі економічні питання, як тривалість перебування хворого в стаціонарі, вартість лікування і в кінцевому підсумку визначає його ефективність.
Ми розглянули потенційні фекальні біомаркери запальних захворювань кишечника і оцінили їх корисність в діапазоні клінічних застосувань. Пошук літератури проводився із застосуванням бази даних PubMed, MEDLAIN та Embase.
На завершення слід сказати, що проблема диференціальної діагностики запальних захворювань кишечника є важливою та актуальною. Її золотим стандартом є використання інструментальних методів. Проте все більшої популярності та поширення набуває використання фекальних маркерів оцінки запального процесу в кишечнику.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
СПИСОК ЛИТЕРАТУРЫ
1. Адлер Г. Болезнь Крона и язвенный колит / Г. Адлер; пер. с нем. А.А. Шептулина. — М.: ГЭОТАР-мед. — 2001. — 528 с.
2. Ивашкин В.Т. Современные подходы к лечению болезни Крона / В.Т. Ивашкин, О.С. Шифрин // Рос. жур. гастроэнтер., гепатол., колопрокт. — 2002. — № 2. — С. 67-73.
3. Белоусова Е.А. Язвенный колит и болезнь Крона / Е.А. Белоусова — Тверь: Триада. — 2002. — 128 с.
4. Степанов Ю.М.,Федорова Н.С. Реалии и перспективы в диагностике заболеваний кишечника // Сучасна гастроентерологія. — 2010. — № 1(51). — С. 109-114.
5. Степанов Ю.М., Щербиніна М.Б., Кононов І.М. Сучасні методи дослідження в гастроентерології: Метод. посіб. — Дніпропетровськ, 2006. — 155 с.
6. Степанов Ю.М., Бойко Т.Й. Хвороба Крона: сучасні підходи до діагностики та лікування. — Дніпропетровськ, 2014. — С. 6-7; 31.
7. Мостовой Ю.М. Сучасні класифікації та стандарти лікування розповсюджених захворювань внутрішніх органів. — 6-те вид., доп. і перероб. / Ю.М. Мостовой. — Вінниця, 2008. — 462 с.
8. Свінціцький А.С. Діагностика та лікування поширених захворювань органів травлення (навчальний посібник) / А.С. Свінціцький. — К.: Медкнига, 2007. — 296 с.
9. Будзак И.Я. К вопросу о дифференциальной диагностике воспалительных и функциональных заболеваний кишечника // Гастроентерологія. — 2013. — № 2(48). — С. 81-85.
10. Маржатка З. Терминология, определение терминов и диагностические критерии в эндоскопии пищеварительного тракта. — 3-е изд. / З. Маржатка. — Hamburg, Germany: Normed Verlag, 1996. — 123 с.
11. Ноздрин В.И. Экспресс-гистология: Учебное пособие. — 4-е изд., доп. и перераб. / В.И. Ноздрин. — М.: ООО «Мед. информ. агентство», 2008. — 208 с.
12. Сергієнко О.І. Особливості терапії неспецифічного виразкового коліту з ураженням печінки / О.І. Сергієнко // Укр. терапевт. журнал. — 2005. — № 1. — С. 32-38.
13. Сергієнко О.І. Ранні прояви і диференційна діагностика хронічних запальних захворювань кишечнику / О.І. Сергієнко / Актуальні питання медичної науки та практики: Зб. наук. праць. — Запоріжжя: Дике поле, 2005. — Вип. 68, Кн. 1. — С. 157-163.
14. Васильченко А.В. Способы повышения эффективности диагностики заболеваний толстой кишки при колоноскопии: Автореф. дис… канд. мед. наук / А.В. Васильченко. — М., 2002. — 19 с.
15. Григорьева Г. Функциональный запор и синдром раздраженного кишечника: дифференциальная диагностика и лечение // Врач. — 2006.— № 2. — С. 3-6.
16. Крилова О.О. Зміни біохімічних показників при хворобі Крона і неспецифічному виразковому коліті // Клін. хір. — 2003. — № 11 (додаток). — С. 153-155.
17. Голышева С.В. Оценка и прогнозирование качества жизни больных с воспалительными заболеваниями кишечника по результатам долгосрочного наблюдения / С.В. Голышева, И.Ю. Мешалкина, Г.А. Григорьева // Гастроэнтерология. — 2005. — № 1–2. — С. 32-36.
18. Григорьев П.Я. Стандарты (протоколы) диагностики и лечения болезней органов пищеварения / Григорьев П.Я., Ивашкин В.Т., Комаров Ф.И. // Практ. врач. — 1998. — № 2. — С. 2-13.
19. Звягінцева Т.Д. Сучасні підходи до діагностики хронічних захворювань кишечнику / Звягінцева Т.Д., Гриднєва С.В. // Укр. терапевт. журн. — 2005. — № 2. — С. 44-48.
20. Комаров Ф. Неспецифический язвенный колит / Комаров Ф.И., Осадчук А.М., Осадчук М.А. — М.: ООО «Медицинское информационное агентство», 2008. — 256 с.
21. Фекальный кальпротектин как биомаркер эффективности различных медицинских вмещательств у больных воспалительными заболеваниями кишечника / Лазебник Л.Б., Гусейн-заде М.Г., Ефремов Л.И. // Экспериментальная и клиническая гастроэнтерология. — 2013. — Вып. 8.
22. Noninvasive markers in the assessment of intestinal inflammation in inflammatory bowel diseases: performance of fecal lactoferrin, calprotectin, and
PMN-elastase, CRP, and clinical indices /Langhorst J., Elsenbruch S., Koelzer J., Rueffer А., Michalsen А., Dobos G.J. // J. Gastroenterol. — 2008. — 103. — P. 162-169.
23. Kefalides P.T. Ulcerative colitis: diagnosis and management / P.T. Kefalides, S.B. Hanauer // Hospital. Physician. — 2002. — № 3. — P. 53-63.
24. Drossman D.A. The functional gastrointestinal disorders and the Rome III process // Gastroenterol. — 2006. — Vol. 130. — P. 1377-1390.
25. Nikolaus S. Diagnostic of inflammatory bowel disease / S. Nikolaus, S. Shreiber // Gastroenterology. — 2007. — Vol. 135, № 5. — P. 1670-1689.
26. Lee D.S. The Role of Endoscopy in Inflammatory Bowel Disease / D.S. Lee // Medscape Gastroenterology J. — 2001. — Vol. 3, № 5. — P. 34-38.
27. Roseth A.G., Aadland E., Fagerhol M.K. et al. Assessment of neutrophil dominating protein calprotectin in feces // Scand. J. Gastroenterol. — 1992. — № 27. — P. 793-798.
28. Scholmerich J. Future developments in diagnosis and treatment of iflammatory bowel disease // Hepato-Gastroenterology. — 2000. — Vol. 47, № 31. — P. 101-114.
29. Best W.R. Development of a Crohn’s disease activity index / W.R. Best, J.M. Becktel, J.W. Singleton. National Cooperative Crohn’s Disease Study // Gastroenterology. — 1976. — № 70. — P. 439-444.
30. Toward complete and accurate reporting of studies of diagnostic accuracy: the STARD initiative / P.M. Bossuyt, J.B. Reitsma, D.E. Bruns et al. // Clin. Chem. — 2003. — № 49. — P. 1-6.
31. Becker W., Fischbach W., Weppler M. et al. Radiolabelled granulocytes in inflammatory bowel disease: diagnostic possibilities and clinical indications // Nucl. Med. Commun. — 1988. — № 9. — P. 693-701.
32. Lorens Meyer H. Inflammatory bowel disease // Lab. Diagnostics. — 2001. — Р. 40.
33. Saverymuttu S.H., Camilleri M., Rees H. et al. Indium 111 Granulocyte scanning in the assessment of disease extent and disease activity in inflammatory bowel disease. A comparison with colonoscopy, histology, and fecal Indium 111Granulocyte Excretion // Gastroenterol. — 1986. — № 90. — P. 1121-1128.
34. Fecal leukocyte proteins in inflammatory bowel disease and irritable bowel syndrome / H. Silberer, B. Kuppers, O. Mickisch et al. // Clin. Lab. — 2005. — № 51. — P. 117-126.
35. Faecal Markers of Gastrointestinal Inflammation / Roy A. Sherwood // J. Clin. Pathol. — 2012. — Vol. 65, № 11. — Р. 981-985.
36. The Role of C-reactive Protein in Inflammatory Bowel Disease / D. Aqbal, A. Abdallah, E. Bolloso et al. // Georgtown Health Sciences. — 2007. — Vol. 4, № 1. — P. 34-36.
37. A new, highly sensitive assay for C-reactive protein can aid the differentiation of inflammatory bowel disorders from constipation — and diarrhoea-predominant functional bowel disorders / A.P. Poullis, S. Zar, K.K. Sundaram et al. // Eur. J. Gastroenterol. Hepatol. — 2002. — Vol. 14, № 4. — P. 409-412.
38. Biomarkers in Inflammatory Bowel Disease: Current Practices and Recent Advances / Heba N. Iskandar and Matthew A. Ciorba // Transl. Res. — 2012. — Vol.
159, № 4. — Р. 313-325.
39. Polymorphisms within the C-reactive protein (CRP) promoter region are associated with plasma CRP levels / C.S. Carlson, S.F. Aldred, P.K. Lee et al. // Am. J. Hum. Genet. — 2005. — № 77. — P. 64-77.
40. Vermeire S. C-reactive protein as a marker for inflammatory bowel disease / S. Vermeire, G. Van Assche, P. Rutgeerts // Inflamm. Bowel Dis. — 2004. — Vol. 10, № 5. — P. 661-665.
41. Henriksen M., Jahnsen J., Lygren I. et al. C-reactive protein: a predictive factor and marker of inflammation in inflammatory bowel disease. Results from a prospective population-based study // Gut. — 2008. — Vol. 57, № 11. — Р. 1518-23.
42. Assessment of endoscopic activity index and biological inflammatory markers in clinically active Crohn’s disease with normal C-protein serum level / M.A. Denis, C. Reenaers, F. Fontaine et al. // Inflamm. Bowel Dis. — 2007. — № 13. — P. 1100-1105.
43. Angriman I., Scarpa M., D’Incà R., Basso D., Ruffolo C., Polese L. et al. Enzymes in feces: useful markers of chronic inflammatory bowel disease // Clin. Chim. Acta. — 2007. — Р. 381; 63-68.
44. Biological Activity Markers in Inflammatory Bowel Disease / D. Деsаi, W.A. Faubion, W.J. Sandbom // Aliment. Pharmacol. Ther. — 2007. — Vol. 25, № 3. — Р. 247-252.
45. Dai J., Liu W.Z., Zhao Y.P, Hu Y.B., Ge Z.Z. Relationship between fecal lactoferrin and inflammatory bowel disease // Scand. J. Gastroenterol. — 2007. — 42. — Р. 1440-1444.
46. Kane S.V., Sandborn W.J., Rufo P.A., Zholudev A., Boone J., Lyerly D. et al. Fecal lactoferrin is a sensitive and specific marker in identifying intestinal inflammation // Am. J. Gastroenterol. — 2003. — 98. — Р. 1309-14.
47. Schoepfer A.M., Trummler M., Seeholzer P., Seibold-Schmid B., Seibold F. Discriminating IBD from IBS: comparison of the test performance of fecal markers, blood leukocytes, CRP, and IBD antibodies // Inflamm. Bowel Dis. — 2008. — Р. 14; 32-39.
48. Schoepfer A.M., Trummler M., Seeholzer P., Criblez D.H., Seibold F. Accuracy of four fecal assays in the diagnosis of colitis // Dis. Colon. Rectum. — 2007. — Р. 50, 1697-1706.
49. Roseth A.G., Aadland E., Jahnsen J., Raknerud N. Assessment of disease activity in ulcerative colitis by faecal calprotectin, a novel granulocyte marker protein // Digestion. — 1997. — Vol. 58, № 2. — P. 176-180.
50. Roseth A.G., Aadland E., Grzyb K. Normalization of faecal calprotectin: a predictor of mucosal healing in patients with infl ammatory bowel disease // Scand. J. Gastroenterol. — 2004. — Vol. 39. — P. 1017-1020.
51. Role of fecal calprotectin as a biomarker of intestinal inflammation in inflammatory bowel disease / Konikoff M.R., Denson L.A. // Inflamm. Bowel Dis. — 2006, Jun. — Vol. 12, № 6. — Р. 524-534.
52. Tibbie J.A., Sigthorsson G., Bridger S. et al. Surrogate markers of intestinal infl ammation are predictive of relapse in patients with infl ammatory bowel disease // Gastroenterology. — 2000. — Vol. 119, № 1. — P. 15-22.
53. Tibble J.A., Bjarnason I. Non-invasive investigations of inflammatory bowel disease // World J. Gastroenterol. — 2001. — Vol. 7. — P. 460-465.
54. Otten C.M., Kok L., Witteman B.J. et al. Diagnostic performance of rapid tests for detection of fecal calprotectin and lactoferrin and their ability to discriminate inflammatory from irritable bower syndrome // Clin. Chem. Lab. Med. — 2008. — Vol. 46, № 9. — P. 1275-1280.
55. Fecal lysozyme in assessment of disease activity in inflammatory bowel disease / van der Sluys Veer A. // Dig. Dis. Sci — 1998. — Vol. 43, № 3. — Р. 590-595.
56. Brouwer J., Biemond I., Bohbouth G.E., Verspaget H.W., Lamers C.B. // Fecal biomarkers of intestinal health and disease in children. Tamara Pang, Steven T. Leach, Tamarah Katz, Andrew S. Day, Chee Y. Ooi. // Pediatric Gastroenterology and Hepatology. — 2014.
57. Peterson C.G., Eklund E., Taha Y., Raab Y., Carlson M. A new method for the quantification of neutrophil and eosinophil cationic proteins in feces: establishment of normal levels and clinical application in patients with inflammatory bowel disease // Am. J. Gastroenterol. — 2002. — 97. — Р. 1755-1762.
58. Peterson C.G., Sangfelt P., Wagner M., Hansson T., Lettesjö H., Carlson M. Fecal levels of leukocyte markers reflect disease activity in patients with ulcerative colitis // Scand. J. Clin. Lab. Invest. — 2007. — 67. — Р. 810-820.
59. Wagner M., Peterson C.G., Ridefelt P., Sangfelt P., Carlson M. Fecal markers of inflammation used as surrogate markers for treatment outcome in relapsing inflammatory bowel disease // World J. Gastroenterol. — 2008. — 14. — Р. 5584-5589.